Klonale Isolierung von Stammzellkolonien
Präzise Isolierung von Stammzellkolonien und Bereichen von Kolonien für die biomedizinische und pharmazeutische Forschung
Stammzellen besitzen eine herausragende Rolle im Bereich der regenerativen Medizin, da sie sich aufgrund ihres hohen Selbsterneuerungs- und Differenzierungspotenzials besonders für ein breites Spektrum von Anwendungen in der biomedizinischen und pharmazeutischen Forschung eignen.
Die Entdeckung, dass die Reprogrammierung von differenzierten Zellen zurück zu pluripotenten Stammzellen (sog. induzierte pluripotente Stammzellen oder iPS-Zellen) möglich ist, hat der Stammzellforschung einen enormen Impuls gegeben. Die Bandbreite der Anwendungen und Forschungsgebiete ist enorm und die Erwartungen sind hoch.
In der Forschung werden iPS-Zellen für die Entwicklung von zellulären Krankheitsmodellen und als Testsysteme für die Entwicklung neuer Medikamente eingesetzt. Darüber hinaus wird iPS-Zellen in der regenerativen Medizin ein therapeutisch relevantes Potenzial für die Entwicklung neuer Therapien für zell- und gewebedegenerative Erkrankungen zugeschrieben. Mit dem Einsatz von iPS-Zellen können nun eine Vielzahl von Gewebetypen gezüchtet werden, die entweder als Ersatzgewebe oder für Forschungszwecke eingesetzt werden können.
Werden zur Herstellung von iPS-Zellen die Ausgangszellen einem Genome Editing unterzogen, erhält man leider keine homogene Zellpopulation, sondern einzelne Zellen mit unterschiedlichen Phänotypen aufgrund abweichender Genintegration. Daher ist es wichtig, das klonale Auswachsen des Einzelzellpools zu beobachten. Um eine klonale Zellpopulation zu erhalten, werden einzelne Zellen zu Klonen gezüchtet und dann einzelne Klone isoliert. Der gesamte Prozess der Generierung klonaler Pools von iPS-Zellen ist sehr zeitaufwendig.
Mit etablierten Methoden werden nur 1 von 100 Gewebezellen oder weniger in iPS-Zellen umgewandelt. Daher besteht ein hoher Bedarf an automatisierten Lösungen sowohl für die Identifizierung als auch für die gezielte Isolierung der gewünschten Stammzellkolonien oder Klone. Die Anforderungen an die Automatisierung sind sehr hoch. Die Zielobjekte müssen eindeutig identifiziert und isoliert werden, ohne dass es zu einer Kreuzkontamination mit benachbarten Klonen kommt. Darüber hinaus müssen die Isolierung und der Transfer so schonend wie möglich erfolgen, um unerwünschte Veränderungen oder Differenzierungen der Zellen zu vermeiden.
Der ALS CellCelector™ mit seinem speziell entwickelten Scrapemodul zur Entnahme von adhärenten Zellen und Zellkolonien ist extrem schonend, sehr spezifisch und daher ideal geeignet für das klonale Passagieren von Stammzellen, Stammzellkolonien sowie für die Isolierung bestimmter Bereiche einer Stammzellkolonie.
Module für die Isolierung von einzelnen Stammzellen, Stammzellkolonien oder spezifischen Bereichen einer Kolonie
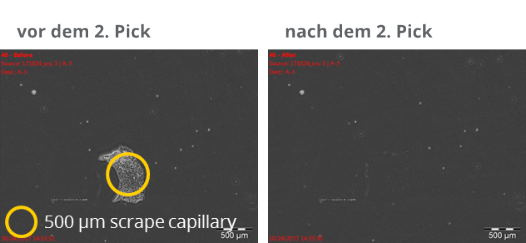
Das Scrapemodul ist das ideale Werkzeug zum Picken ganzer Kolonien oder großer Bereiche einer Kolonie.
Verschiedene Durchmesser erlauben dem Anwender, das passende ScrapeTip™ für jede Kolonie auszuwählen.

Das Einzelzellmodul kann sowohl für die exakte Isolierung spezifischer Bereiche einer Kolonie. z.B. undifferenzierter Gebiete innerhalb einer Stammzellkolonie als auch für die Isolierung einzelner Stammzellen verwendet werden. Das Modul verwendet eine Glaskapillare, die in unterschiedlichen Durchmessern von 20 µm bis 220 µm erhältlich ist.

Das Pickmodul für halbfeste Medien ist optimal für die Isolierung von 3D Kolonien, wie z.B. embryoid bodies, Spheroide, Organoide oder hämatopoetische Stammzellkolonien geeignet. Abhängig von der Größe der Kolonie kann zwischen zwei verschiedenen Durchmessern gewählt werden.

Anwendungen
- Klonales Picken neu gewonnener iPS-Kolonien
- Picken von Kolonien nach Genome Editing (CRISPR)
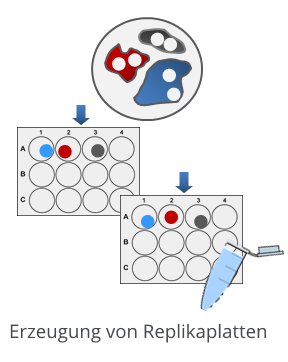
- Splitten von Kolonien mit Transfer in 2 oder 3 Zielplatten (Erstellung von Replikaplatten)
- Isolierung von differenzierten Stammzellkolonien
- Scannen und Isolieren von hämatopoetischen Stammzellkolonien aus Methylzellulose
- Isolierung einzelner Stammzellen (Einzelzellklonierung oder Heterogenitätsstudien)
- Reinigung von Stammzellkulturen durch Entfernen differenzierter Bereiche
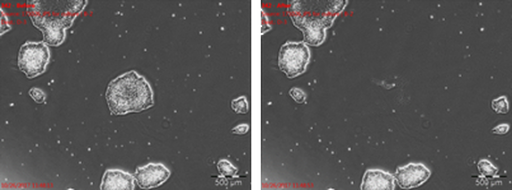
Automatisierte Isolierung induzierter pluripotenter Stammzellen (iPS) und embryonaler Stammzellkolonien mit dem ALS CellCelector™
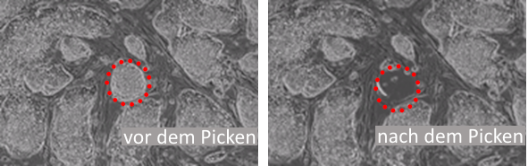
Die Übertragung von Stammzellkolonien ist oft ein für die Zellen strapaziöser Vorgang, der in einer großen Zahl toter Zellen resultiert, die ihre lebenden Nachbarn beeinflussen. Die Verwendung von Trypsin oder ähnlichen enzymatischen Verdauungsmethoden zur Erleichterung des Transfers der Kolonien kann deutliche Auswirkungen auf den Phänotyp insbesondere von frisch reprogrammierten Stammzellen haben und zu einer unbeabsichtigten Differenzierung führen. Außerdem kann es zur Kreuzkontamination verschiedener Kolonien führen, wobei die Klonalität verloren geht. Die Durchführung eines mechanischen Transfers mittels manuellem Schaben mit Pipettenspitzen oder Zellschabern ist jedoch aufwendig und erfüllt kaum die Voraussetzungen für einen klonalen Kolonientransfer. Daher ist es entscheidend, eine schonende mechanische Transfermethode mit hoher Spezifität zu implementieren, die sowohl die Lebensfähigkeit als auch die Klonalität der gepflückten Kolonien maximiert und gleichzeitig ihre pluripotenten Eigenschaften erhält.
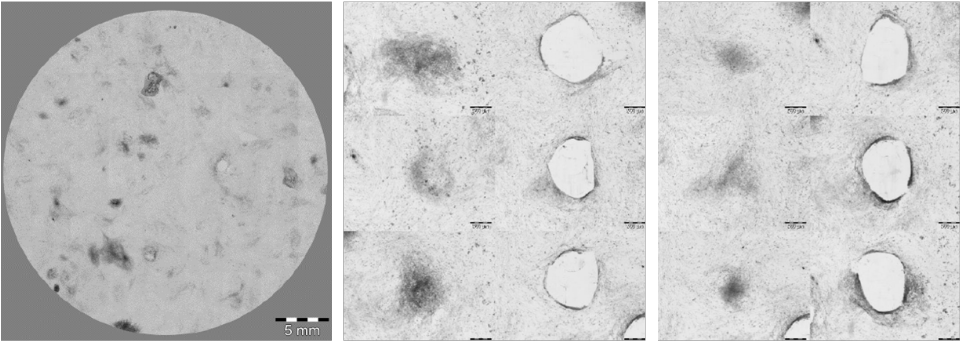
Automatisierte Isolierung von iPS Kolonien: Das Übersichtsbild zeigt den gesamten Scan des entsprechenden Wells (Bild links), Bilder vor und nach dem Picken dokumentieren den Pickprozess (Mitte und rechts).
Sanfte Ablösung adhärenter Zellen für eine hohe Lebensfähigkeit unter Beibehaltung der Pluripotenz
Für das Picken von adhärenten Kolonien kombiniert der ALS CellCelector™ eine sehr sanfte, kreuzweise Kratzbewegung mit gleichzeitigem Aufsaugen der Kolonie. Dadurch wird die Kolonie sanft vom Boden der Kulturplatte oder von der Feeder-Zellschicht gelöst.
Die Propidiumiodid (PI)-Färbung wurde verwendet, um das Überleben der Zellen von manuell und automatisiert gepickten hESC-Kolonien nach dem Transfer in eine neue Platte zu beurteilen.
Die Bilder zeigen eine geringere Anzahl toter Zellen bei der automatischen Isolierung im Vergleich zur manuellen Entnahme.
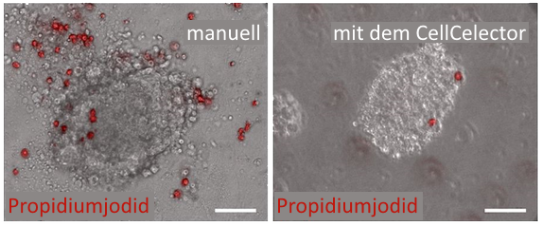
Phasenkontrastbilder von humanen embryonalen Stammzellen (hESCs) überlagert mit den korrespondierenden Fluoreszenzbildern der PI Färbung (Maßstabsbalken 50 µm)
Links: manuell gepickte Kolonien, rechts: mit dem CellCelector gepickte Kolonien nach dem Transfer.
Auch die Morphologie einer Kolonie kann wichtige Informationen über ihren aktuellen Zustand liefern. Eine Phasenkontrastaufnahme einer repräsentativen Kolonie wurde 3 Tage (links) und 5 Tage (rechts) nach der automatisierten Passage in eine neue Kulturschale erstellt. Die Kolonie zeigte ein normales Wachstum. Dies belegt, dass automatisiert mit dem CellCelector™ gepickte Stammzellkolonien keine signifikanten Unterschiede zu manuell gepickten Kolonien derselben Passage aufweisen. Auch das Wachstumsverhalten ist vergleichbar.
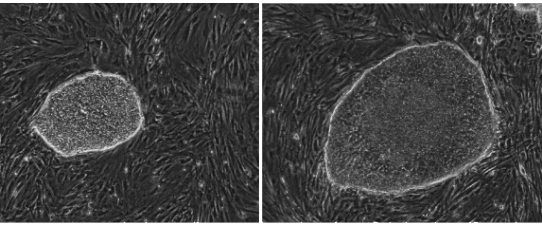
Phasenkontrastbild einer representativen Kolonie nach automatisierter Passage in eine neue Kulturschale
Links: 3 Tage nach der Passage; rechts: 5 Tage nach der Passage
Um zu testen, wie die Stammzellen auf den CellCelector™ Entnahmeprozess in Bezug auf ihren Pluripotenz-Zustand reagieren, wurden die hESC-Kolonien auf die pluripotenzassoziierten Marker Oct4, SSEA-1, Tra-1-60 und Nanog gefärbt.
Die immunozytochemische Expressionsanalyse typischer Marker ist eine zuverlässige Methode zur Beurteilung der Auswirkungen des Zelltransfers. Bestimmte Proteine, die eine zentrale Rolle bei der Aufrechterhaltung der Pluripotenz oder der Bestimmung des Zellschicksals spielen, können mit fluoreszenzmarkierten Antikörpern sichtbar gemacht werden und sind mit der Imaging-Software des CellCelector™ leicht zu erkennen.
Die Pluripotenz von hESC-Kolonien konnte bestätigt werden, die Expressionsniveaus sind mit denen konventionell vermehrter hESCs vergleichbar.
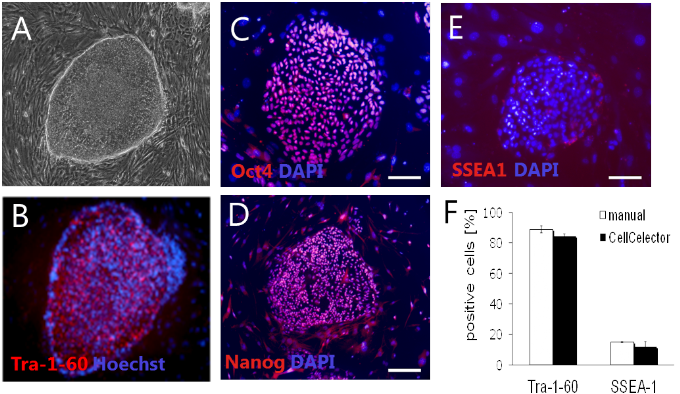
Immunozytochemische Färbung für den pluripotenzassoziierten Oberflächenmarker Tra-1-60 (B), die Pluripotenzfaktoren Oct4 (C) und Nanog (D) sowie SSEA-1, einen Oberflächenmarker für differenzierte menschliche Zellen (E). Die primären Antikörper wurden mit Alexa-555-gekoppelten sekundären Antikörpern sichtbar gemacht. Die Zellkerne wurden mit Hoechst oder DAPI gegengefärbt.
(F) Die Quantifizierung der Zellen, die den Pluripotenz-assoziierten Marker Tra-1-60 und den Differenzierungsmarker SSEA-1 exprimieren, erfolgte mittels FACS-Analyse.
Isolierung undifferenzierter Stammzellkolonien von Feederzellen
Die Co-Kultivierung undifferenzierter Stammzellen auf Feeder-Zellen (meist Fibroblasten) ist eine häufig verwendete Methode, um eine Umgebung zu schaffen, die die Stammzellen stabil und lebensfähig hält.
Die Isolierung von Stammzellen ohne Übertragung von Feeder-Zellen erfordert jedoch besondere Fähigkeiten. Der ALS CellCelector™ ermöglicht einen automatischen Transfer von Stammzellkolonien aus Feederzellen.
Humane embryonale Stammzellen (hESC) auf Feeder-Zellen
Klonales Picken nach Genome Editing
Genetisch veränderte Modellorganismen sind für die Untersuchung biologischer Zusammenhänge und die Untersuchung von Krankheiten von großer Bedeutung, da mit ihnen die Funktion und Regulierung von Genen in der physiologischen Umwelt untersucht werden kann. Mit ihrer Hilfe lassen sich in der Grundlagenforschung neue Erkenntnisse gewinnen, die sich in neuen Therapieformen niederschlagen können.
Der erste Schritt der klassischen Methode zur Erzeugung transgener Organismen besteht in der Transfektion embryonaler Stammzellen und der anschließenden Selektion positiver Klone. Der ALS CellCelector™ ist durch die Kombination einer ausgeklügelten Bilddokumentation von der Einzelzelle bis zum Klon mit einer präzisen und schonenden Isolierung und einem sanften Transfer der gewachsenen Klone ideal für die klonale Entnahme einzelner Zellkolonien geeignet.
Erzeugung von Replikaplatten
Ist die Größe der Kolonie ausreichend, kann eine einzelne Kolonie automatisch in zwei oder mehr Replikatplatten verteilt werden. Eine Zielplatte dient dann der Kultivierung, während die andere für die Qualitätskontrolle mittels PCR-Analyse zur Verfügung steht.
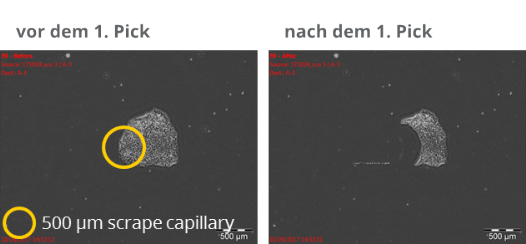
Isolierung spezifischer Teile einer Stammzellkolonie
Aufgrund seiner leistungsfähigen Optik und Bildbearbeitungssoftware sowie seiner hohen Präzision kann der ALS CellCelector™ auch spezifische Bereiche aus Stammzellkolonien isolieren. Basierend auf den morphologischen Eigenschaften und Unterschieden der Stammzellkolonien kann der CellCelector™ zum Beispiel zwischen differenzierten und undifferenzierten Teilen einer Kolonie unterscheiden und diese selektiv herauspicken.
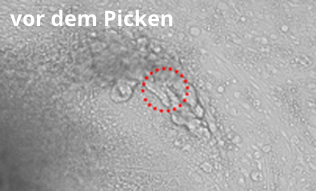
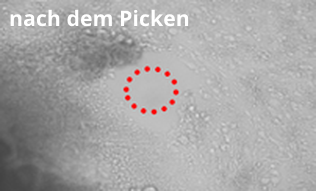
Isolierung schon ausdifferenzierter Bereiche einer hESC Kolonie mit dem ALS CellCelector™.
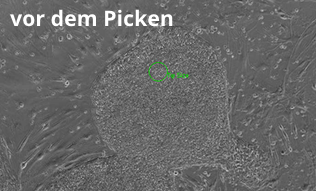
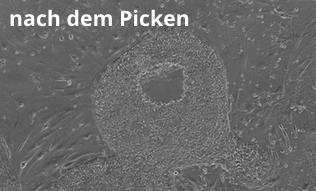
Transfer spezifischer, undifferenzierter Bereiche einer humanen embryonalen Stammzellkolonie (hESC) unter Verwendung des Einzelzellmoduls auf dem ALS CellCelector™.
Isolierung von Embryoid Bodies (EB) aus halbfestem Medium
Stammzellkolonien können mithilfe hochviskoser Medien wie Methylzellulose oder Matrigel in 3D kultiviert werden, um Organoide oder Embryoid Bodies zu bilden, die für die pharmazeutische Forschung und für Studien zur Organbildung interessant sind. Der CellCelector™ mit seinem speziellen Pickmodul für halbfeste Medien eignet sich hervorragend für die Isolierung dieser Strukturen.


WEITERFÜHRENDE PUBLIKATIONEN
- Cohen, I.S. et al. DNA lesion identity drives choice of damage tolerance pathway in murine cell chromosomes Nucl. Acids Res. 43(3): 1637-45 (2015)
- Shipony, Z. et al. Dynamic and static maintenance of epigenetic memory in pluripotent and somatic cells Nature 513(7516): 115-9 (2014)
- Marx, U. et al. Automatic Production of Induced Pluripotent Stem Cells Procedia CIRP 5: 2-6 (2013)
- Haupt, S. et al. Automated selection and harvesting of pluripotent stem cell colonies Biotechnol. Appl. Biochem. 59(2): 77-87 (2012)
- Zoldan, K. et al. Automated harvest of induced pluripotent stem cell colonies and colony fractions using the cell separation robot CellCelectorTM nature methods application notes (2010)
- Zoldan, K. et al. Automated isolation of semi-adherent macrophage-like cells from a fibroblast-contaminated culture using the cell separation robot CellcelectorTM nature methods application notes (2010)
- Haupt, S. et al. Automated selection and harvesting of pluripotent stem cell colonies using the CellCelector Nature Methods (2009)
- Schneider, A. et al. "The good into the pot, the bad into the crop!" - a new technology to free stem cells from feeder cells PLoS One 3(11): e3788 (2008)
- Peterbauer, T. et al. Simple and versatile methods for fabrication of arrays of live mammalian cells Lab on a Chip 6(7): 857-63 (2006)
- Planes, E. et al. Life Cell Imaging for Quality Control of Pluripotent Stem Cell Culture Poster ISSCR 2013 Boston
Möchten Sie mehr erfahren?


